Ковалентная связь: полярная и неполярная, свойства и примеры
 Ковалентная связь осуществляется за счёт обобществления электронов, принадлежащих обоим участвующим во взаимодействии атомам. Электроотрицательности неметаллов достаточно велики, поэтому передачи электронов не происходит.
Ковалентная связь осуществляется за счёт обобществления электронов, принадлежащих обоим участвующим во взаимодействии атомам. Электроотрицательности неметаллов достаточно велики, поэтому передачи электронов не происходит.
Электроны, находящиеся на перекрывающихся электронных орбиталях, поступают в общее пользование. При этом создаётся ситуация, при которой внешние электронные уровни атомов оказываются заполненными, то есть образуется 8-ми или 2-х электронная внешняя оболочка.
Оглавление:
Состояние, при котором электронная оболочка заполнена полностью, характеризуется наименьшей энергией, а соответственно, и максимальной устойчивостью.
Механизмов образования два:
- донорно-акцепторный;
- обменный.
В первом случае один из атомов предоставляет свою пару электронов, а второй — свободную электронную орбиталь.
Это интересно: как расставлять коэффициенты в химических уравнениях?
Во втором — в общую пару приходит по одному электрону от каждого участника взаимодействия.
В зависимости от того, к какому типу относятся — атомному или молекулярному, соединения с подобным видом связи могут значительно различаться по физико-химическим характеристикам.
Ковалентная неполярная химическая связь
Молекулярные вещества чаще всего газы, жидкость или твёрдые вещества с низкими температурами плавления и кипения, неэлектропроводные, обладающие малой прочностью. К ним можно отнести: водород (H 2), кислород (O 2), азот (N 2), хлор (Cl 2), бром (Br 2), ромбическую серу (S 8), белый фосфор (P 4) и другие простые вещества; диоксид углерода (CO 2), диоксид серы (SO 2), оксид азота V (N 2 O 5), воду (H 2 O), хлороводород (HCl), фтороводород (HF), аммиак (NH 3), метан (CH 4), этиловый спирт (C 2 H 5 OH), органические полимеры и другие.
Это интересно: алканы — химические свойства предельных углеводородов.
Вещества атомные существуют в виде прочных кристаллов, имеющих высокие температуры кипения и плавления, не растворимы в воде и прочих растворителях, многие не проводят электрический ток. Как пример можно привести алмаз, который обладает исключительной прочностью. Это объясняется тем, что алмаз представляет собой кристалл, состоящий из атомов углерода, соединённых ковалентными связями. В алмазе нет отдельных молекул. Также атомным строением обладают такие вещества, как графит, кремний (Si), диоксид кремния (SiO 2), карбид кремния (SiC) и другие.
 Ковалентные связи могут быть не только одинарными (как в молекуле хлора Cl2), но также двойные, как в молекуле кислорода О2, или тройные, как, например, в молекуле азота N2. При этом тройные имеют большую энергию и более прочны, чем двойные и одинарные.
Ковалентные связи могут быть не только одинарными (как в молекуле хлора Cl2), но также двойные, как в молекуле кислорода О2, или тройные, как, например, в молекуле азота N2. При этом тройные имеют большую энергию и более прочны, чем двойные и одинарные.
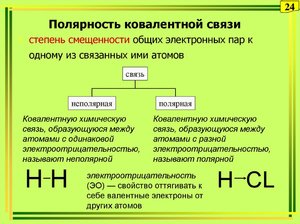
Ковалентная связь может быть образована как между двумя атомами одного элемента (неполярная), так и между атомами различных химических элементов (полярная).
Указать формулу соединения с ковалентной полярной связью не представляет труда, если сравнить значения электроотрицательностей, входящих в состав молекул атомов. Отсутствие разницы в электроотрицательности определит неполярность. Если же разница есть, то молекула будет полярна.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Ковалентная неполярная химическая связь
Характерна для простых веществ неметаллов. Электроны принадлежат атомам в равной степени, и смещения электронной плотности не происходит.
Примером могут служить следующие молекулы:
H2, O2, О3, N2, F2, Cl2.
Исключением являются инертные газы. Их внешний энергетический уровень заполнен полностью, и образование молекул им энергетически не выгодно, в связи с чем они существуют в виде отдельных атомов.
Также примером веществ с неполярной ковалентной связью будет, например, РН3. Несмотря на то, что вещество состоит из различных элементов, значения электроотрицательностей элементов фактически не различаются, а значит, смещения электронной пары происходить не будет.
Видео: Виды химической связи: ионная, ковалентная полярная и неполярная, донорно-акцепторная
Ковалентная полярная химическая связь
Рассматривая ковалентную полярную связь, примеров можно привести множество: HCl, H2O, H2S, NH3, CH4, CO2, SO3, CCl4, SiO2, СО.
Ковалентная полярная связь образуется между атомами неметаллов с различной электроотрицательностью. При этом ядро элемента с большей электроотрицательностью притягивает общие электроны ближе к себе.
Схема образования ковалентной полярной связи
В зависимости от механизма образования общими могут становиться электроны одного из атомов или обоих.
На картинке наглядно представлено взаимодействие в молекуле соляной кислоты.
Пара электронов принадлежит и одному атому, и второму, у обоих, таким образом, внешние уровни заполнены. Но более электроотрицательный хлор притягивает пару электронов чуть ближе к себе (при этом она остаётся общей). Разница в электроотрицательности недостаточно большая, чтобы пара электронов перешла к одному из атомов полностью. В результате возникает частичный отрицательный заряд у хлора и частичный положительный у водорода. Молекула HCl является полярной молекулой.
Физико-химические свойства связи
Связь можно охарактеризовать следующими свойствами: направленность, полярность, поляризуемость и насыщаемость.
 Насыщаемость — характеристика, определяющая, сколько связей способен сформировать атом.
Насыщаемость — характеристика, определяющая, сколько связей способен сформировать атом.- Направленность — свойство, которое зависит от строения образующейся молекулы, от её геометрической формы. Направленность обуславливается тем, что перекрывающиеся орбитали имеют определённую ориентацию в пространстве.
- Полярность определяется смещением электронной плотности ближе к одному из ядер атомов. Это свойство характеризуется такой величиной, как дипольный момент.
- Поляризуемость определяет, насколько сильно меняется полярность молекулы под действием внешних сил (электромагнитного поля, например).
 Насыщаемость — характеристика, определяющая, сколько связей способен сформировать атом.
Насыщаемость — характеристика, определяющая, сколько связей способен сформировать атом.



 1
1