Алканы — предельные углеводороды, их химические свойства
 Углеводороды представляют собой простейшие органические соединения. Их составляют углерод и водород. Соединения этих двух элементов называются предельными углеводородами или алканами. Их состав выражается общей для алканов формулой CnH2n+2, где n — количество атомов углерода.
Углеводороды представляют собой простейшие органические соединения. Их составляют углерод и водород. Соединения этих двух элементов называются предельными углеводородами или алканами. Их состав выражается общей для алканов формулой CnH2n+2, где n — количество атомов углерода.
Оглавление:
Алканы — международное наименование данных соединений. Также эти соединения называют парафинами и насыщенными углеводородами. Связь в молекулах алканов простая (или одинарная). Остальные валентности насыщены атомами водорода. Все алканы насыщены водородом до предела, его атомы находятся в состоянии sp3-гибридизации .
Гомологический ряд предельных углеводородов
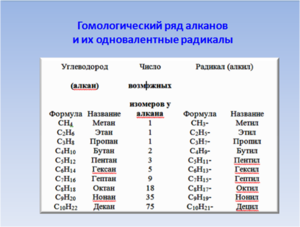
 Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан — C2H6, пропан C3H8, бутан — C4H10.
Первым в гомологическом ряду насыщенных углеводородов стоит метан. Его формула CH4. Окончание -ан в наименовании предельных углеводородов являет отличительным признаком. Далее в соответствии с приведенной формулой в гомологическом ряду располагаются этан — C2H6, пропан C3H8, бутан — C4H10.
С пятого алкана в гомологическом ряду названия соединений образуются следующим образом: греческое число, указывающее число атомов углеводорода в молекуле + окончание -ан. Так, по-гречески число 5 — пэндэ, соответственно за бутаном идет пентан — C5H12. Далее — гексан C6H14. гептан — C7H16, октан — C8H18, нонан — C9H20, декан — C10H22 и т. д.
Физические свойства алканов заметно изменяются в гомологическом ряду: увеличивается температура плавления, кипения, увеличивается плотность. Метан, этан, пропан, бутан при обычных условиях, т. е. при температуре равной примерно 22 градуса тепла по Цельсию, являются газами, с пентана по гексадекан включительно — жидкостями, с гептадекана — твердыми веществами. Начиная с бутана, у алканов есть изомеры.
Это интересно: нуклеотид это что такое? Его строение, масса, длина и последовательность.
Существуют таблицы, отражающие изменения в гомологическом ряду алканов, которые наглядно отражают их физические свойства.
Номенклатура насыщенных углеводородов, их производные
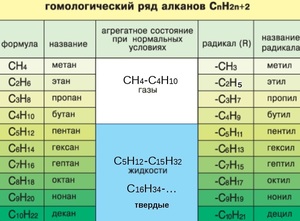 Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана — этил, из пропана — пропил и т. д.
Если происходит отрыв атома водорода от молекулы углеводорода, то образуются одновалентные частицы, которые называют радикалами (R). Название радикалу дает то углеводород, из которого этот радикал произведен, при этом окончание -ан меняется на окончание -ил. Например, из метана при отрыве атома водорода образуется радикал метил, из этана — этил, из пропана — пропил и т. д.
Радикалы также образуются и неорганическими соединениям. Например, отняв у азотной кислоты гидроксильную группу ОН, можно получить одновалентный радикал -NO2, который называется нитрогруппой.
При отрыве от молекулы алкана двух атомов водорода образуется двухвалентные радикалы, названия которых также образуются из названия соответствующих углеводородов, но окончание меняется на:
- илиен, в том случае, если атомы водорода оторваны от одного атома углерода,
- илен, в том случае, если от двух атомы водорода оторваны от двух соседних атомов углерода.
Алканы: химические свойства
Рассмотрим реакции, характерные для алканов. Всем алканам присущи общие химические свойства. Данные вещества являются малоактивными.
Все известные реакции с участием углеводородов подразделяются на два вида:
- разрыв связи С-Н (примером может служить реакция замещения);
- разрыв связи С-С (крекинг, образование отдельных частей).
Очень активны в момент образования радикалы. Сами по себе они существуют доли секунды. Радикалы легко вступают в реакции между собой. Их неспаренные электроны образуют новую ковалентную связь. Пример: CH3 + CH3 → C2H6
Радикалы легко вступают в реакции с молекулами органических веществ. Они либо присоединяются к ним, либо отрывают от них атом с неспаренным электроном, в результате чего появляются новые радикалы, которые, в свою очередь, могут вступать в реакции с другими молекулами. При такой цепной реакции получаются макромолекулы, которые перестают расти только тогда, когда оборвется цепь (пример: соединение двух радикалов)
Реакции свободных радикалов объясняют многие важные химические процессы, такие как:
- Взрывы;
- Окисления;
- Крекинг нефти;
- Полимеризацию непредельных соединений.
 Подробно можно рассмотреть химические свойства насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации , и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Подробно можно рассмотреть химические свойства насыщенных углеводородов на примере метана. Выше мы уже рассматривали строение молекулы алкана. Атомы углерода находятся в молекуле метана в состоянии sp3-гибридизации , и образуется достаточно прочная связь. Метан представляет собой газ баз запаха и цвета. Он легче воздуха. В воде малорастворим.
Алканы могут гореть. Горит метан синеватым бледным пламенем. При этом результатом реакции будут оксид углерода и вода. При смешивании с воздухом, а также в смеси с кислородом, особенно если соотношение объемов будет 1:2, данные углеводород образует взрывчатые смеси, из-за чего он крайне опасен для применения в быту и шахтах. Если метан сгорает не полностью, то образуется сажа. В промышленности ее таким образом и получают.
Из метана получают формальдегид и метиловый спирт путем его окисления в присутствии катализаторов. Если же метан сильно нагреть, то он распадается по формуле CH4 → C + 2H2
Распад метана можно осуществить до промежуточного продукта в специально оборудованных печах. Промежуточным продуктом будет ацетилен. Формула реакции 2CH4 → C2H2 + 3H2. Выделение ацетилена из метана сокращает расходы производства почти в два раза.
Также из метана получают водород, производя конверсию метана с водяным паром. Характерными для метана являются реакции замещения. Так, при обычной температуре, на свету галогены (Cl, Br) по стадиям вытесняют водород из молекулы метана. Таким образом образуются вещества, называемые галогенопроизводными. Атомы хлора, замещая в молекуле углеводорода атомы водорода, образуют смесь разных соединений.
В такой смеси присутствуют хлорметан (CH3 Cl или хлористый метил), дихлорметан (CH2Cl2или хлористый метилен), трихлорметан (CHCl3 или хлороформ), тетрахлорметан (CCl4 или четыреххлористый углерод).
Любое из этих соединений может быть выделено из смеси. В производстве важное значение отводится хлороформу и тетрахлорметану, в силу того, что они являются растворителями органических соединений (жиров, смол, каучука). Галогенопроизводные метана образуются по цепному свободнорадикальному механизму.
Свет воздействует на молекулы хлора, вследствие чего они распадаются на неорганические радикалы, которые отрывают атом водорода с одним электроном от молекулы метана. При этом образуется HCl и метил. Метил реагирует с молекулой хлора, в результате чего получается галогенопроизводное и радикал хлора. Далее радикал хлора продолжает цепную реакцию.
При обычной температуре метан обладает достаточной стойкостью к щелочам, кислотам, многим окислителям. Исключение — азотная кислота. В реакции с ней образуется нитрометан и вода.
Реакции присоединения для метана не характерны, т. к. все валентности в его молекуле насыщены.
Реакции, в которых участвуют углеводороды могут проходить не только с расщеплением связи С-Н , но и с разрывом связи С-С . Такие превращения происходят при наличии высоких температур и катализаторов. К таким реакциям относятся дегидрогенизация и крекинг.
Из насыщенных углеводородов путем окисления получают кислоты — уксусную (из бутана), жирные кислоты (из парафина).
Получение метана
 В природе метан распространен достаточно широко. Он — главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот. Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно. Они используются как топливо, на различных производствах, в медицине и технике.
В природе метан распространен достаточно широко. Он — главная составная часть большинства горючих природных и искусственных газов. Он выделяется из каменноугольных пластов в рудниках, со дна болот. Природные газы (что очень заметно в попутных газах нефтяных месторождений) содержат не только метан, но и другие алканы. Применение этих веществ разнообразно. Они используются как топливо, на различных производствах, в медицине и технике.
В условиях лаборатории данный газ выделяют при нагревании смеси ацетат натрия + гидроксид натрия, а также реакцией карбида алюминия и воды. Также метан получают из простых веществ. Для этого обязательными условиями являются нагрев и катализатор. Промышленное значение имеет получение метана синтезом на основе водяного пара.
Метан и его гомологи могут быть получены при прокаливании солей соответствующих органических кислот с щелочами. Еще одним способом получения алканов является реакция Вюрца, при которой нагреваются моногалогенопроизводные с металлическим натрием. Онтология читайте у нас на сайте.




 1
1