Механизм образования водородной связи
 Гидрогенная связь — образовывается между «+» заряженными атомами водорода и «-» заряженными атомами других молекул.
Гидрогенная связь — образовывается между «+» заряженными атомами водорода и «-» заряженными атомами других молекул.
Очень часто эта взаимосвязь возникает и существует из-за взаимодействия атома водорода с такими атомами: оксиген (О), нитроген (N). Это происходит вследствие того, что данные элементы имеют небольшой удельный вес и характеризуются высокой электроотрицательностью. Элементы, которые имеют больший удельный вес — сера S или хлор Cl—связываются с водородом менее прочно, хотя их электроотрицательность сравнима с нитрогеном.
Оглавление:
Типы гидрогенной связи
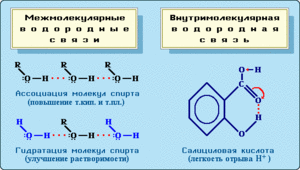
- Межмолекулярная водородная — возникает между двумя элементами, пример: метиловый спирт.
- Водородная (гидрогенная) внутримолекулярная — образуется внутри элемента, пример: 2-нитрофенол.
Это интересно: механизм образования металлической химической связи, примеры.
Межмолекулярная гидрогенная связь
 Совместная электронная пара смещается от атома водорода к отрицательно заряженному атому. При этом водород входит в комплекс с неразделенной электронной парой другого атома или иона.
Совместная электронная пара смещается от атома водорода к отрицательно заряженному атому. При этом водород входит в комплекс с неразделенной электронной парой другого атома или иона.
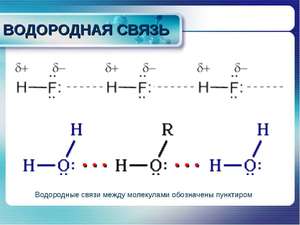
Н-связь графически изображают в виде точек, тем самым показывая, что она слабее ковалентной (примерно в 10−15 раз).
Молекулы воды (две) и молекулы уксусной кислоты (две)
Внутримолекулярная гидрогенная взаимосвязь. Ей свойственно находиться в таких структурах, как многоатомные спирты, углеводы, белки.
Это интересно: типы кристаллических решеток — таблица различных материалов.
Молекула салициловой кислоты
Химические взаимодействия делятся на слабые и сильные. Их отличие состоит в том, что при разрыве они выделяют разную энергию и у них различные по длине (расстояние между атомами):
1. Слабые. Содержание энергии — 15−25 кдж/моль, длина равна 30.
2. Сильные. Энергия — 300 кдж/моль, длина 22−23.
Для образования Н-св. характерно два типа отдачи ионов — электростатический и донорно — акцепторный. Интересно то, что донором выступает более сильный элемент (F, O, N), а акцептором — атом водорода.
Это интересно: как определить валентность по таблице Менделеева?
Механизм образования водородной связи
Хорошо разбирать механизм образования водородной связи на примере её между молекулами воды. Н-св. на рисунках обозначается 3 точками. Атом гидрогена имеет всего лишь один электрон, который при взаимодействии с атомом большей электроотрицательности может условно оголять ядро, что, в свою очередь, образует дополнительную взаимосвязь с другим атомом. Это и есть водородная связь.
Вода — это вещество, между молекулами которого образуются водородные связи.
Кластеры из нескольких молекул воды
Благодаря водородным взаимосвязям молекулы воды взаимодействуют друг с другом, что приводит к образованию кластеров или комплексов воды. Одним из ярких примеров является димер воды.
Н-св. считаются довольно слабыми и неустойчивыми: считается, что они легко возникают, но и также легко разрушаются. Для водородных связей характерен симптом тепловой флюктуации. Вода представляет собой сеть из молекул, связанных водородными связями.
Аномальные свойства, обеспеченные водородной взаимосвязью
 Молекула воды состоит из трёх молекул и содержит 4 Н-св. Здесь присутствуют 2 атома водорода , а кислород, имея две неподеленные электронные пары, связывается с атомами Н ближайших молекул Н2О.
Молекула воды состоит из трёх молекул и содержит 4 Н-св. Здесь присутствуют 2 атома водорода , а кислород, имея две неподеленные электронные пары, связывается с атомами Н ближайших молекул Н2О.
Н-св. обеспечивают высокие температуры кипения и плавления. Без них эти показатели были бы намного меньше.
Н-св. в молекулах воды обладают достаточной силой и препятствуют её плавлению и испарению.
А также они обеспечивают ещё одно свойство Н2О, которое характеризуется тем, что при плавлении воды её плотность повышается.
Наибольшее значение имеет плотность воды (1,00 г/мл) при температуре 4 градуса Цельсия. Эта температура характерна для зимнего времени и находится на дне пресных водоёмов, там же и находится вода с максимальной плотностью.
Как изменяются свойства веществ в зависимости от водородной связи
Наиболее достоверным признаком наличия в веществе межмолекулярной Н-св. является показатель кипения вещества. Одна из высоких температур кипения у воды (100 oC так как для того чтобы разрушить межмолекулярные связи в H2O нужно затратить больше энергии). Н-св. сильно может влиять на физические и химические свойства вещества. Межмолекулярная связь обеспечивает повышение температуры плавления и кипения различных веществ. Вещества, которые содержат ОН-группы —моносахариды, дисахариды, как правило, обладают отличной гидрофильностью.






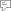 1
1