Физические и химические свойства кальция и его роль в природе
Кальций (Ca) – легкий агрессивный металл серебристого цвета с беловатым оттенком. Он играет важную роль во многих сферах жизни. В свободном виде в природе его нет, так как он химически высокоактивен.
Оглавление:
История открытия
В первом десятилетии 19-го века Хэмфри Дэви получил вещество без примесей. Он взял для электролиза катод на основе ртути и увлажненную гашеную известь. На первом этапе результат – сплав кальция и ртути. На втором, после удаления ртутной части – чистый элемент.
История названия «кальций» берет начало в том же веке от латинского “calx”, что переводится как известь.
Однако в древнем мире слово уже употреблялось для описания некоторых процессов, например для обжига известняка, гашения извести. Сам процесс термической обработки позднее получил название «кальцинация».
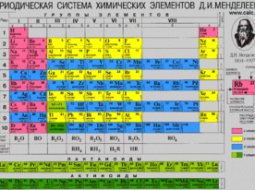
Кальций в таблице Менделеева
В системе Менделеева занимает 20 порядковое место, что относится ко второй группе и четвертому периоду.
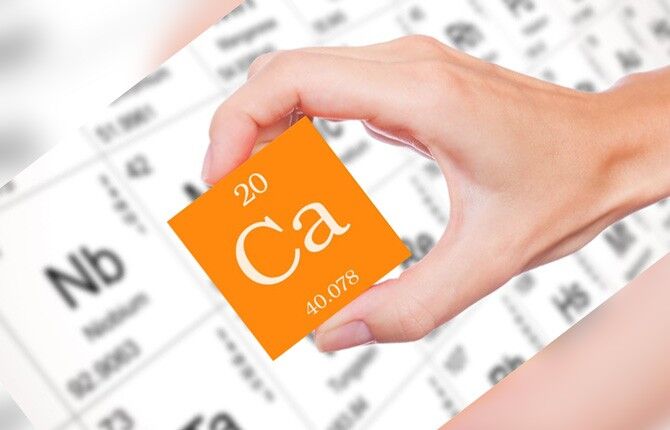
Атомная масса вещества – 40,078 г/моль. Это металл, входящий в категорию щелочноземельных, s-семейство.
Строение атома
Атом имеет положительно заряженное ядро и область вокруг него с орбиталями. Ядро любого атома содержит протоны и нейтроны, соответственно, положительно и нейтрально заряженные частицы.
Ядро атома кальция содержит по 20 протонов и нейтронов. В области вокруг него находится 4 орбитали, по которым движется 20 электронов – отрицательно заряженных частиц. При этом электроны располагаются в порядке 2, 8, 8, 2.

Последняя орбиталь в электронном строении описывается как 4S², имеет 2 спаренных электрона, из-за чего валентность элемента равна 2. При образовании соединений отдает 2 электрона с внешнего слоя, выполняет функцию окислителя. Степень окисления равна +2.
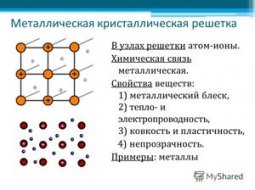
Физические свойства
Это твердый металл серебряного цвета с беловатым оттенком в нормальных условиях. При постепенном нагревании переходит в жидкое агрегатное состояние, потом в газообразное.
| Параметр | Значение |
| Плавление | При 842°С |
| Кипение | При 1484°С |
| Плотность | 1,55 г/см³ |
Хорошо подвергается различным манипуляциям – режется, прессуется, прокатывается.

Аллотропия – способность химического элемента существовать в виде двух и более простых веществ, которые различаются по свойствам, химическому строению. Существует две аллотропные модификации:
- альфа-Ca, устойчивый до 443°С;
- бета-Ca, устойчив при температурах выше 443°С.
Различаются они моделью кубической решетки. У α-Ca она гранецентрированная, а у β-Ca объемноцентрированная.
Химический свойства
Является типичным представителем семейства щелочноземельных металлов. Кальций вступает в реакции с разными веществами, так как является химически активным.
Несмотря на свою высокую способность к взаимодействию, кальций не самый активный металл семейства. Степень окисления +2.
Кальций вступает в следующие химические реакции:
- С кислородом взаимодействует в нормальных условиях, образуя оксид и выделяя тепло. Может даже загореться чистым красным огнем и белым дымом. Образуется оксид кальция — 2Ca + O₂ -> 2CaO.
- С галогенами реагирует в нормальных условиях — Ca + Br₂ -> CaBr₂ – бромид.
- С углеродом дает реакцию при нагреве. Аналогичными будут взаимодействия с водородом, кремнием и другими неметаллами — Ca + 2C -> CaC₂ – карбид.
- С кислотами, иногда с мощным выделением тепла. Выделяют 2 варианта уравнения реакции кальция с серной кислотой: Ca + H₂SO₄(разбавленная) -> CaSO₄ + 2H₂ и Ca + H₂SO₄(концентрированная) -> CaSO₄ + SO₂ + 2H₂O. В обоих случаях результатом реакции будет соль сульфат, побочные продукты.
- С водой реакция проходит с выделением тепла, но без воспламенений — Ca + 2H₂O -> Ca(OH)2 + H₂.
На воздухе металл покрывается сероватым налетом.

В реакции вступает много соединений элемента:
- Соединения кальция и неметаллов в присутствии воды разлагаются до гидроксида, водорода — CaH₂ + H₂O -> Ca(OH)₂ + 2H₂.
- Существует особенный перенос веществ, а именно превращение из карбоната в кислую его версию и обратно в разных условиях.
- При реакции воды, обогащенной углекислым газом, с карбонатом кальция выделяется кислый карбонат, одновременно происходит растворение — СаСО3 + СО2 + Н2О = Са(НСО3)2.
- В обратном случае кислый карбонат кальция нагревается под солнцем распадаясь на 3 компонента — Са(НСО3)2 = СаСО3 + СО2↑ + Н2О.
Рекомендовано не хранить кальций в открытом виде, а убирать в герметичную стеклянную посуду с добавлением парафина или керосина.
Кальций в природе
В целом вещество является пятым по распространенности на планете. К осадочным породам с кальцием в составе относят меловые отложения и известняк. В основном они состоят из кальцита, который в кристаллической форме представляет собой мрамор.
Элемент способен мигрировать в земной коре и из-за своей активности вступать в различные реакции, образуя минералы. Насчитывается более 380 минералов с участием этого компонента. Часто встречаются:
- кальцит;
- ангидрит;
- апатит;
- доломит.
Элемент содержится и в живых организмах. Большая часть, а именно гидроксиапатит, приходится на клетки костей, зубов. У губок, кораллов скелет целиком состоит из карбоната кальция.

Применение
В редких случаях кальций используется как самостоятельный компонент, чаще он находится в других веществах. В чистом виде применяется в восстановительных реакциях металлов из оксидов.
В металлургии востребован для удаления окислений или для получения трудно восстанавливаемых металлов, например урана или хрома.
В свинцовый аккумуляторах кальций используют как небольшую добавку. От общего объема вещества его меньше 1%. Однако этого достаточно, чтобы не дать аккумулятору перегреться или закипеть. Дополнительно элемент защищает основное вещество, свинец, от коррозии.
Используется для огнеупорных материалов и средств.
Соединения кальция применяются для получения:
- Водорода вне лаборатории из гидрида.
- Ацетилена и цианамида из карбида.
Каждый хоть раз видел мел, гипс, известняк. Первый используется для письма на досках, второй – в медицине и строительстве зданий, а третий – в качестве стройматериала, а также для пищевой, химической промышленности.
Из элемента поучают:
- негашеную известь (CaO – оксид);
- гашеную известь (Ca(OH)2 – гидроксид).
Отмечают биологическую роль элемента. Живым организмам он нужен для нормального сердцебиения. Его ионы участвуют в передаче сигнала по нервным клеткам, в работе мышц, в процессе свертывания крови.
Без кальция не существовало бы многих отраслей промышленности и даже жизни, так как он является важным макроэлементом.
А что вам известно о кальции? Сохраняйте статью, чтобы не потерять полезную информацию, делитесь ею в социальных сетях.
Также рекомендуем посмотреть подобранные видео по нашей теме.
Различные опыты с кальцием.
Химический элемент кальций.
Карбонат и гидрокарбонат кальция.
Источники:
- https://www.chem100.ru/elem.php?n=20
- https://allmetalls.ru/ca.html
- https://ru.wikipedia.org/wiki/Кальций
- http://www.mining-enc.ru/k/kalcij



 1
1