Металлическая связь: механизм образования и примеры
 В одноатомном состоянии при обычных условиях находятся только благородные газы. Остальные же элементы не существуют в виде индивидуальном, так как имеют возможность взаимодействовать между собой или с другими атомами. При этом образуются более сложные частицы.
В одноатомном состоянии при обычных условиях находятся только благородные газы. Остальные же элементы не существуют в виде индивидуальном, так как имеют возможность взаимодействовать между собой или с другими атомами. При этом образуются более сложные частицы.
Оглавление:
Совокупность атомов может образовать следующие частицы:
- молекулы;
- молекулярные ионы;
- свободные радикалы.
Типы химического взаимодействия
Взаимодействие между атомами называют химической связью. Основой являются электростатические силы (силы взаимодействия электрических зарядов), которые действуют между атомами, носителями этих сил являются ядро атома и электроны.
Это интересно: полярная и неполярная ковалентная связь — что это?
Электронам, находящимся на внешнем энергетическом уровне, отведена основная роль в образовании химических связей между атомами. Они наиболее удалены от ядра, а, следовательно, связаны с ним наименее прочно. Их называют валентными электронами.
Частицы взаимодействуют между собой различными способами, что приводит к образованию молекул (и веществ) разного строения. Различают следующие типы химической связи:
- ионная;
- ковалентная;
- водородная;
- вандерваальсова;
- металлическая.
Говоря о различных типах химического взаимодействия между атомами, стоит помнить о том, что все типы одинаково основаны на электростатическом взаимодействии частиц.
Это интересно: алканы — химические свойства предельных углеводородов.
Металлическая химическая связь
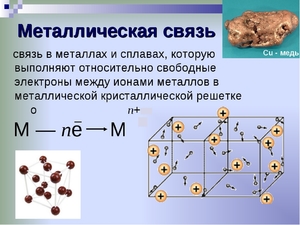 Как видно из положения металлов в таблице химических элементов, они, в большинстве своём, обладают небольшим числом валентных электронов. Электроны связаны со своими ядрами достаточно слабо и легко отрываются от них. В результате этого образуются положительно заряженные ионы металла и свободные электроны.
Как видно из положения металлов в таблице химических элементов, они, в большинстве своём, обладают небольшим числом валентных электронов. Электроны связаны со своими ядрами достаточно слабо и легко отрываются от них. В результате этого образуются положительно заряженные ионы металла и свободные электроны.
Эти электроны, свободно перемещающиеся в кристаллической решётке, называют «электронным газом».
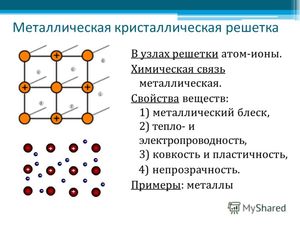
На рисунке схематично изображено строение вещества металла.
То есть в объёме металла атомы постоянно превращаются в ионы (их называют атом-ионами) и наоборот ионы постоянно принимают электроны из «электронного газа».
Это интересно: как расставлять коэффициенты в химических уравнениях?
Механизм образования металлической связи можно записать в виде формулы:
атом M0 — ne ↔ ион Mn+
Таким образом, металлы представляют собой положительные ионы, которые расположены в кристаллической решётке в определённых положениях, и электроны, которые могут достаточно свободно перемещаться между атом-ионами.
Кристаллическая решётка представляет «скелет», остов вещества, а электроны перемещаются между её узлами. Формы кристаллических решёток металлов могут быть различными, например:
- объёмно-центрическая кубическая решётка характерна для щелочных металлов;
- гранецентрическую кубическую решётку имеют, например, цинк, алюминий, медь, другие переходные элементы;
- гексагональная форма типична для щёлочноземельных элементов (исключением является барий);
- тетрагональная структура — у индия;
- ромбоэдрическая — у ртути.
Пример кристаллической решётки металла показан на картинке ниже.
Отличия от других видов
 Отличается металлическая связь от ковалентной по прочности. Энергия металлических связей меньше, чем ковалентных в 3−4 раза и меньше энергии ионной связи.
Отличается металлическая связь от ковалентной по прочности. Энергия металлических связей меньше, чем ковалентных в 3−4 раза и меньше энергии ионной связи.
В случае с металлической связью, нельзя говорить и о направленности, ковалентная связь строго направлена в пространстве.
Такая характеристика, как насыщаемость также не характерна для взаимодействия между атомами металлов. В то время как ковалентные связи являются насыщаемыми, то есть количество атомов, с которыми может произойти взаимодействие, строго ограничено количеством валентных электронов.
Схема связи и примеры
Процесс, происходящий в металле можно записать с помощью формулы:
К — е К +
Al — 3e Al3+
Na — e Na+
Zn — 2e Zn2+
Fe — 3e Fe3+
Если описывать более подробно, металлическую связь, как образуется этот тип связи, необходимо рассматривать строение внешних энергетических уровней элемента.
В качестве примера можно рассмотреть натрий. Имеющийся на внешнем уровне единственный валентный 3s электрон может свободно перемещаться по свободным орбиталям третьего энергетического уровня. При сближении атомов натрия, происходит перекрывание орбиталей. Теперь уже все электроны могут перемещаться между атом-ионами в пределах всех пререкрывшихся орбиталей.
У цинка на 2 валентных электрона приходится целых 15 свободных орбиталей на четвёртом энергетическом уровне. При взаимодействии атомов эти свободные орбитали будут перекрываться, как бы обобществляя электроны, которые по ним перемещаются.
У атомов хрома валентных электронов 6 и все они будут участвовать в образовании электронного газа и связывать атом-ионы.
Свойства металлов
 Особый вид взаимодействия, который характерен для атомов металлов, определяет ряд объединяющих их свойств и отличающих металлы от других веществ. Примерами таких свойств являются высокие температуры плавления, высокие температуры кипения, ковкость, способность отражать свет, высокая электропроводность и теплопроводность.
Особый вид взаимодействия, который характерен для атомов металлов, определяет ряд объединяющих их свойств и отличающих металлы от других веществ. Примерами таких свойств являются высокие температуры плавления, высокие температуры кипения, ковкость, способность отражать свет, высокая электропроводность и теплопроводность.
Высокие температуры плавления и кипения объясняются тем, что катионы металла прочно связаны электронным газом. При этом прослеживается закономерность, что прочность связи увеличивается с увеличением количества валентных электронов. Например, рубидий и калий являются легкоплавкими веществами (температуры плавления 39 и 63 градуса Цельсия, соответственно), по сравнению с, например, хромом (1615 градусов Цельсия).
Равномерностью распределения валентных электронов по кристаллу объясняется, например, такое свойство металлов, как пластичность — смещение ионов и атомов в любых направлениях без разрушения взаимодействия между ними.
Свободное перемещение электронов по атомным орбиталям объясняет и электропроводность металлов. Электронный газ при наложении разности потенциалов переходит из хаотического движения к движению направленному.
В промышленности часто используют не чистые металлы, а их смеси, называемые сплавами. В сплаве свойства одного компонента обычно удачно дополняют свойства другого.
Металлический тип взаимодействия характерен как для чистых металлов, так и для их смесей — сплавов, находящихся в твёрдом и жидком состояниях. Однако, если металл перевести в газообразное состояние, то связь между его атомами будет ковалентная. Металл в виде пара состоит и отдельных молекул (одно- или двухатомных).




 1
1
Физика образования металлической связи написана ясным и понятным языком. хочется поблагодарить коллегу за этот раздел. С уважением Вячеслав.